Salut à tous !
Voici un tuto expliquant comment fabriquer une pile électrique très peu de moyens en extérieur. Nous alimenterons avec une petite radio FM, et nous terminerons avec une petite astuce qui vous permettra de récupérer du magnésium pur dans vos fonds de tiroir.

C'était à la base l'article que j'ai proposé à un membre de l'équipe de rédaction du Mag Survival, ici :
https://instinct-de-survie.forumgratuit.org/t11030-proposition-d-article-fabrication-d-une-pile-outdoor
Mais cela a pris beaucoup de temps (depuis novembre), normalement cela aurait dû paraître d'abord dans le Mag, afin de proposer une nouveauté, puis sur les forums les semaines suivantes pour compléter.
Donc à ceux qui nous rejoignent depuis le Mag Survival, voici la version complète de l'article, qui ne pouvait bien entendu pas entrer correctement dans le Mag, car elle prend 40 pages au total.
La version allégée s'étend sur 9 pages A4, tandis que celle du Mag condensée par la rédaction en fait 4 au maximum avec les photos...chapeau car c'était pas évident de proposer l'essentiel du propos sur si peu de place
Pour ceux qui préfèrent la version PDF, voici le fichier hébergé sur les serveurs d'Olduvaï (forum à l'origine de l'article) :
http://oldu.fr/docs/index.php?dir=1_Electricite/&file=Fabriquez_une_pile_de_fortune_avec_votre_bloc_de_magnesium.pdf
N'hésitez pas à poser ici vos questions et surtout à montrer vos réalisations
Il s'agit d'une petite amélioration de mon précédent article ici :
https://instinct-de-survie.forumgratuit.org/t6021-les-piles-diy-du-survivant
J'ai souhaité aller un peu plus loin ici ; vous aurez en effet des valeurs beaucoup plus précises de tension, d'intensité ainsi que les caractéristiques globales de notre pile. En effet, la plupart des expériences proposent les valeurs limites de tension et d'intensité, et multipliant l'une par l'autre pour estimer une puissance maximale. Mais dans la pratique cela ne fonctionne pas du tout, car plus on l’intensité débitée est élevée (plus « on tire » sur la pile), plus la tension s'effondre. Ces deux grandeurs sont intrinsèquement liées.
Nous verrons au travers de ce tuto que de nombreux concepts de chimie et d'électricité interviendront.
En effet, les piles métal-air fonctionnent avec de nombreux métaux. En mode bug-in, je suggèrerais plutôt l'aluminium, très présent dans toutes les habitations, sous forme de papier aluminium, d’emballage de tablettes de chocolat, ou encore de barquettes alimentaires. Un simple rouleau d’une dizaine de mètres permettrait de réaliser des centaines de piles Al-air, dont vous retrouverez les étapes de fabrication via le lien ci-dessus. Le seul facteur limitant sera plutôt le charbon.
Mais en bug-out, c'est à dire dans une situation "nomade", avec des ressources limitées, j'ai voulu proposer une possibilité qui réalise le meilleur compromis, avec ce que bon nombre d’entre nous possède déjà dans son paquetage : le bloc de magnésium.
On a donc un item qui peut faire double-emploi : il aide à allumer un feu (la poudre s'enflamme facilement) mais aussi à réaliser une pile électrique.
Le magnésium a un énorme avantage sur tous les autres métaux pour notre pile : la tension produite est l'une des plus élevées de toutes les expériences DIY réalisables.
Là où avec l'aluminium on produit péniblement 0,7V (1,2V théoriques) et où il faut soit relier plusieurs éléments en série soit ajouter un survolteur, avec le magnésium on peut atteindre une tension théorique de 3,1V !
Dans la pratique, sur le terrain et avec la plupart des électrolytes, nous obtiendrons environ 1,9V à vide. C'est beaucoup plus élevé que la plupart des piles que l'on peut trouver dans les expériences de chimie, comme la pile au citron Cuivre-Zinc.
C'est à dire qu'avec votre "pile de brousse", vous pourriez alimenter directement de petits appareils.
Enfin, je n'ai pas trouvé de tuto similaire sur les différents forums et sites web de notre thématique.
Si je ne me trompe pas, voici donc une première -et "frenchie"- dans le monde survival/bushcraft qui, je l'espère, ajoutera une corde supplémentaire à votre arc.
Il vous faudra :
- Votre bloc de magnésium. Mon modèle est un item d’entrée de gamme acheté 5 euros dans un magasin de rando.
- une électrode de charbon de récup. Une mine graphite de crayon à papier peut tout à fait convenir.
- du charbon actif. Celui-de ce tuto est issu de granulés d'un filtre à air. On peut utiliser tout type de charbon actif : d'aquarium, de masque à gaz, de cartouche filtrante (sans les granules échangeurs d'ions). Il est censé augmenter la surface de contact électrode/dioxygène/électrolyte, et donc augmenter l'intensité disponible.
Dans l’absolu, tout ce qui est en carbone assez pur fonctionne (électrode de pile, charbon de bois, crayon graphite, etc. le tout broyé), l'essentiel est d'avoir un composé neutre dans la réaction tout en étant bon conducteur électrique.
A l'extrême, pourquoi pas retenter la construction avec du charbon de bois récupéré du prochain barbeuc.
- des fils de connexion.
- un papier filtre à café ou du tissu assez fin.
- un peu de sel et d’eau

En premier lieu, je broie le charbon actif pour réaliser une poudre grossière :

Elle est ensuite enveloppée dans notre papier-tissu avec une électrode au milieu. C'est le même process qu'avec la pile aluminium-air.
L'ensemble est humidifié à l'aide de notre eau salée. J'ai utilisé 4g pour environ 20mL.
L'électrode avec le charbon actif sera la borne positive. Celle avec le magnésium sera la borne négative.

Si l'on analyse un peu la réaction chimique, cela devient évident.
L'électrode négative est appelée Anode (pensez au "n") ; elle va subir l'oxydation du magnésium en fournissant des électrons.
Réaction à l’anode : Mg -> Mg2+ + 2e-
A la cathode, le dioxygène de l'air est réduit en hydroxyde via l'eau de la solution
Réaction à l’anode Cathode: O2 + 2H2O + 4e- -> 4OH-
Mg2+g et OH- se combinent ensuite pour former de l'hydroxyde de magnésium, un solide blanc insoluble, qui va apparaître progressivement.
Soit l’équation bilan :
2Mg + O2 + 2H2O -> 2Mg(OH)2
Une pile qui fonctionne avec du Magnésium, de l’Oxygène et de l’eau salée
L’électrolyte de notre pile est tout simplement de l’eau salée à 20% (en g/L), c’est à dire à 200g pour 1000mL.
Cela représente environ 4 cuillères à café rases de sel pour une tasse à café d’eau. Ou bien 8 cuillères pour un gobelet en plastique jetable. Il n’est pas nécessaire d’être précis sur ce point, car le sel sert uniquement à rendre l'eau conductrice, et n'entre pas dans la réaction.
Avec notre solution, nous allons humidifier le charbon et la membrane. Il ne faut pas noyer l’ensemble car la réaction nécessite de l’oxygène, qui est apporté par le dioxygène présent dans l’air.
Le magnésium métallique Mg à la surface de notre bloc va être oxydé et se transformer en ion magnésium Mg2+ en perdant des électrons, qui vont être captés par l’électrode métallique. On la nomme « anode » dans le cas d’un générateur car elle fournit les électrons.
Le dioxygène de l’air O2 va être « réduit » au contact du charbon actif en se combinant à l’eau et en consommant des électrons pour former des ions hydroxyde OH-
D’un côté on a un excès d’électrons, de l’autre on a une carence. Si on relie ces deux électrodes avec un fil métallique, on permet aux électrons de circuler, donc on permet aux réactions de continuer. On forme alors tout simplement un circuit électrique.
Passons à la pratique !
Pour tracer la courbe caractéristique de notre pile, j'ai formé un circuit avec une résistance ajustable d'environ 100k. 100k opposent une résistance maximale, donc une intensité minimale tandis qu'au bas de l'échelle, nous descendons à quelques dizaines d'ohms, donc nous obtiendrons une intensité maximale.
J’ai utilisé deux multimètres, l’un permettant de suivre la tension, en mode Voltmètre, l’autre permettant de suivre l’intensité, en mode Ampèremètre.
La tension à vide (force électromotrice) de notre pile est de 1.9V.

Pas mal pour une pile de survie
Ici, c’est à peine moins car il y a en réalité ici 100k aux bornes de notre pile.
Donc, selon la loi d'ohm U = R*I (et I = U/R), une intensité de 19µA, invisible sur ce calibre de l'ampèremètre. J'ai oublié ce point lors de l'expérience...
C'est bien mieux que les piles AlO2, qui arrivent assez péniblement à 0.7V, mais aussi des piles cuivre/zinc que l'on bidouille avec les citrons (0.9V).
Petit rappel :
- une intensité est un débit d'électrons. C'est comme mesurer le débit d'une rivière. L'instrument de mesure - un ampèremètre- se place donc sur le chemin du courant. C'est pourquoi on dit qu'il est "en série" dans le circuit.
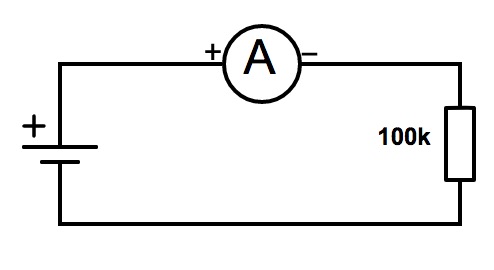
- une tension est une différence de potentiel entre deux points et se mesure donc "aux bornes d'un dipôle", ici une résistance.
C'est pourquoi on place l'instrument de mesure -un voltmètre- en parallèle à un composant dans le circuit.

Si l'on souhaite suivre l'évolution des deux paramètres en même temps, il suffit de placer les deux instruments comme suit :
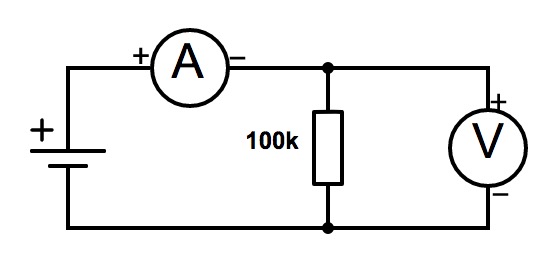
Théoriquement, ces instruments ne perturbent pas le circuit. Cela reste vrai dans la plupart des montages usuels, comme celui-ci.
Mais dès que l'on touche aux circuits oscillants (radio, HF, etc.) ou à forte impédance (alim de compteur Geiger...), ils risquent de les faire un peu dévier.
Puis on réalise des mesures à différentes valeurs d'intensité :
1.81V lorsque ma résistance laisse passer un courant de 1,5mA.

Mesure avec un courant de presque 10mA débité dans la résistance :

etc.
Je suis monté à presque 0.5 ampères, mais la tension est tombée à 0.2 volts !
A noter que faire débiter de fort courant à une pile l’endommage un peu, comme une pile normale. La tension maximale va progressivement décroître avec l’utilisation. Lors de la réaction chimique, de l’eau est consommée et un oxyde métallique est produit.
Si l’on souhaite repartir de zéro, il suffit de nettoyer un peu le bloc de magnésium et de rincer à l’eau claire le charbon. La réaction va continuer tant que le métal, le dioxygène et l’électrolyte sont disponibles.
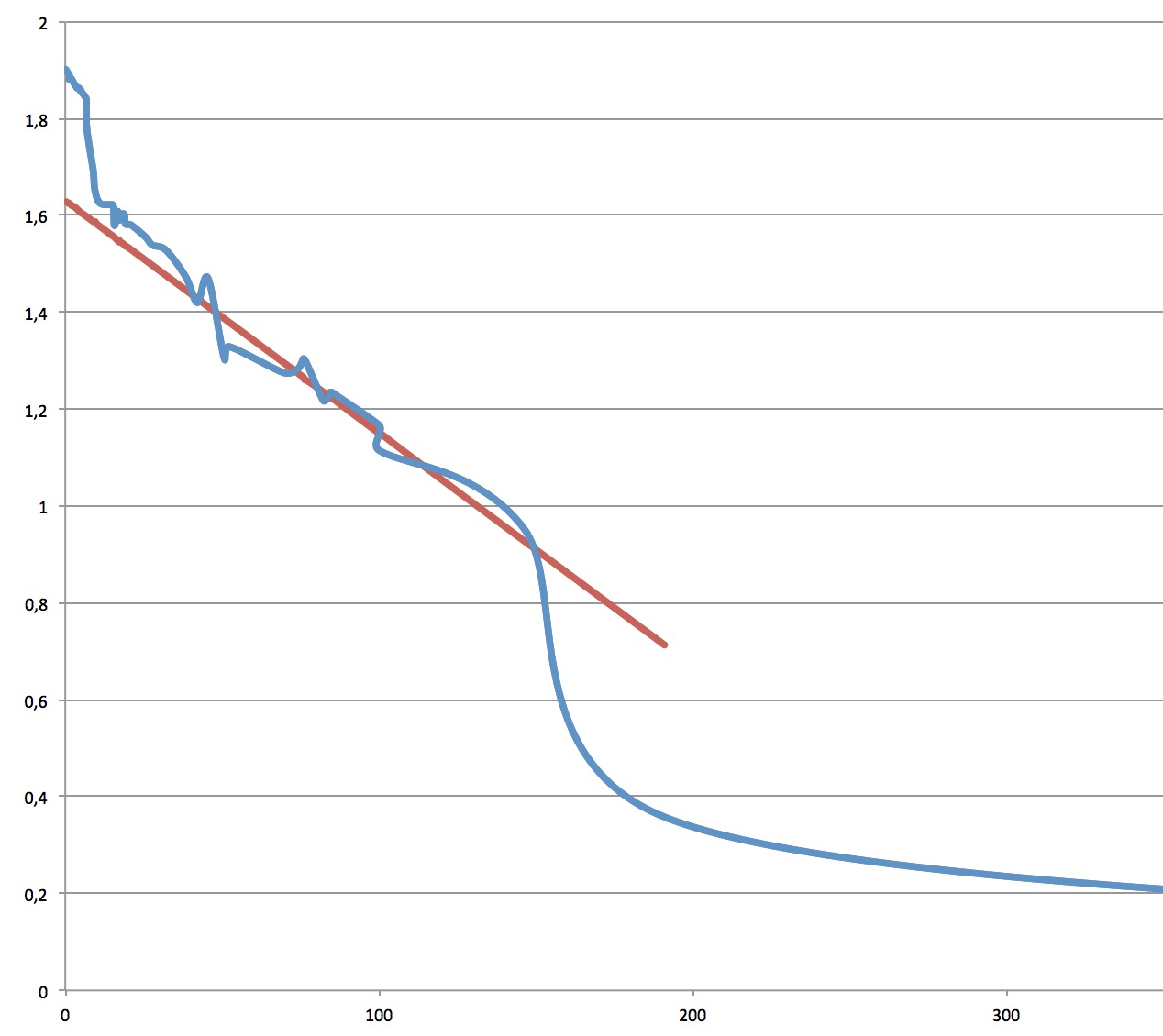
Voici la courbe caractéristique de notre pile, qui représente la tension (en volts, en ordonnées) qui varie selon l'intensité du courant dans le circuit (en milliampères, en abscisses).
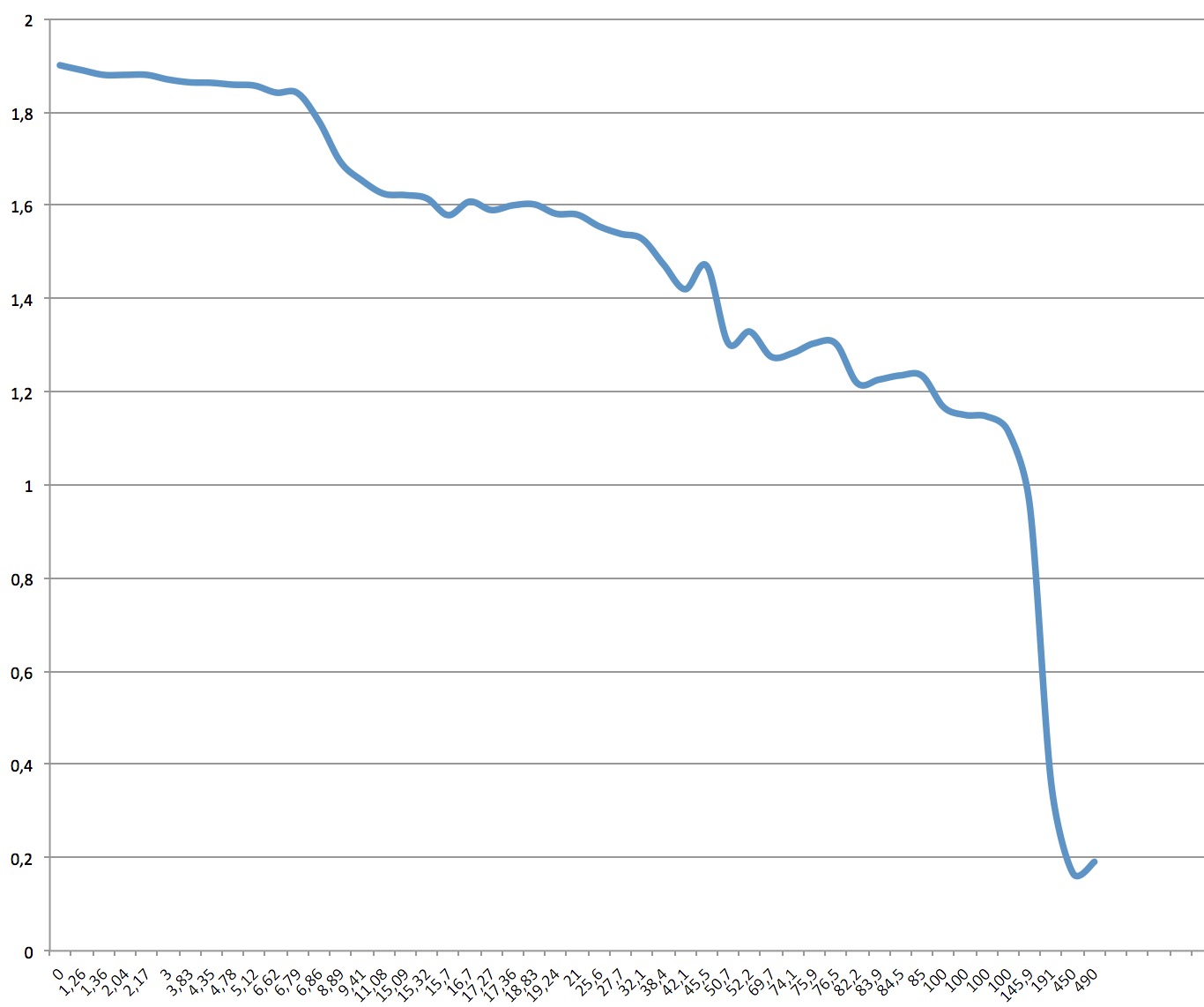
On remarque que
- pour les faibles courants, en dessous de 5mA, la tension reste assez stable autour de 1.8V.
- entre 5mA et 100mA, la tension décroît en suivant presque une droite,
- au dessus de 100mA, la tension s'effondre. On s'approche alors d'un court-circuit.
C'est tout à fait normal car la surface des électrodes où se produit la réaction chimique est très petite, à peine 4 cm2 ; on ne peut fournir une quantité illimitée de courant.
Très sommairement et sans entrer dans les détails, notre pile présente une f.e.m (tension à vide), mais aussi une résistance interne, due à ses constituants. C'est comme si on avait une résistance supplémentaire en série dans le circuit, qui va faire d'autant chuter la tension que l'intensité demandée est élevée.
La tension U d'une pile s'écrit en général U = f.e.m - R * I.
A noter que la résistance interne va dépendre de l'électrolyte et de la concentration des ions en solution...mais aussi de la surface des électrodes.
Plus cette surface sera grande, plus notre pile pourra fournir de courant, et donc tenir la charge face à des intensités importantes.
Essayons de calculer R : On va voir qu'elle varie un petit peu au cours de l'expérience.
Pour les faibles intensités, on peut modéliser la caractéristique par U = 1,9- 8*I. La résistance interne est de huit ohms.
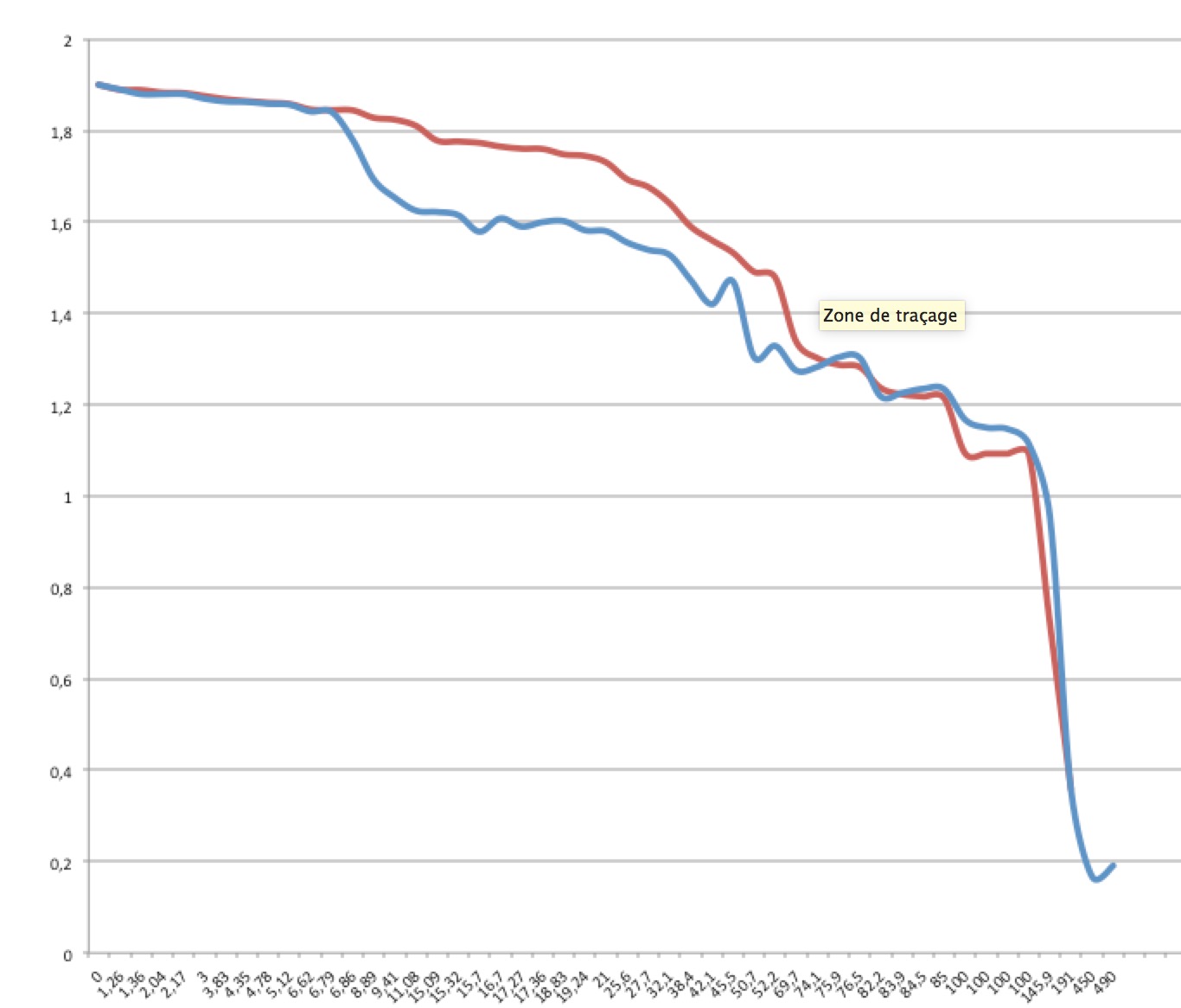
Mais à partir de 5mA, on s'éloigne drastiquement de la réalité.
Astuce pour ceux qui utilisent les tableurs : il est quasi-impossible d'avoir une échelle linéaire en abscisse avec les graphiques en mode ligne.
Il faut alors utiliser les nuages de points avec lignes de jonction, ce qui revient quasi- au même !
Avec une échelle linéaire, cet éloignement à la réalité saute aux yeux :
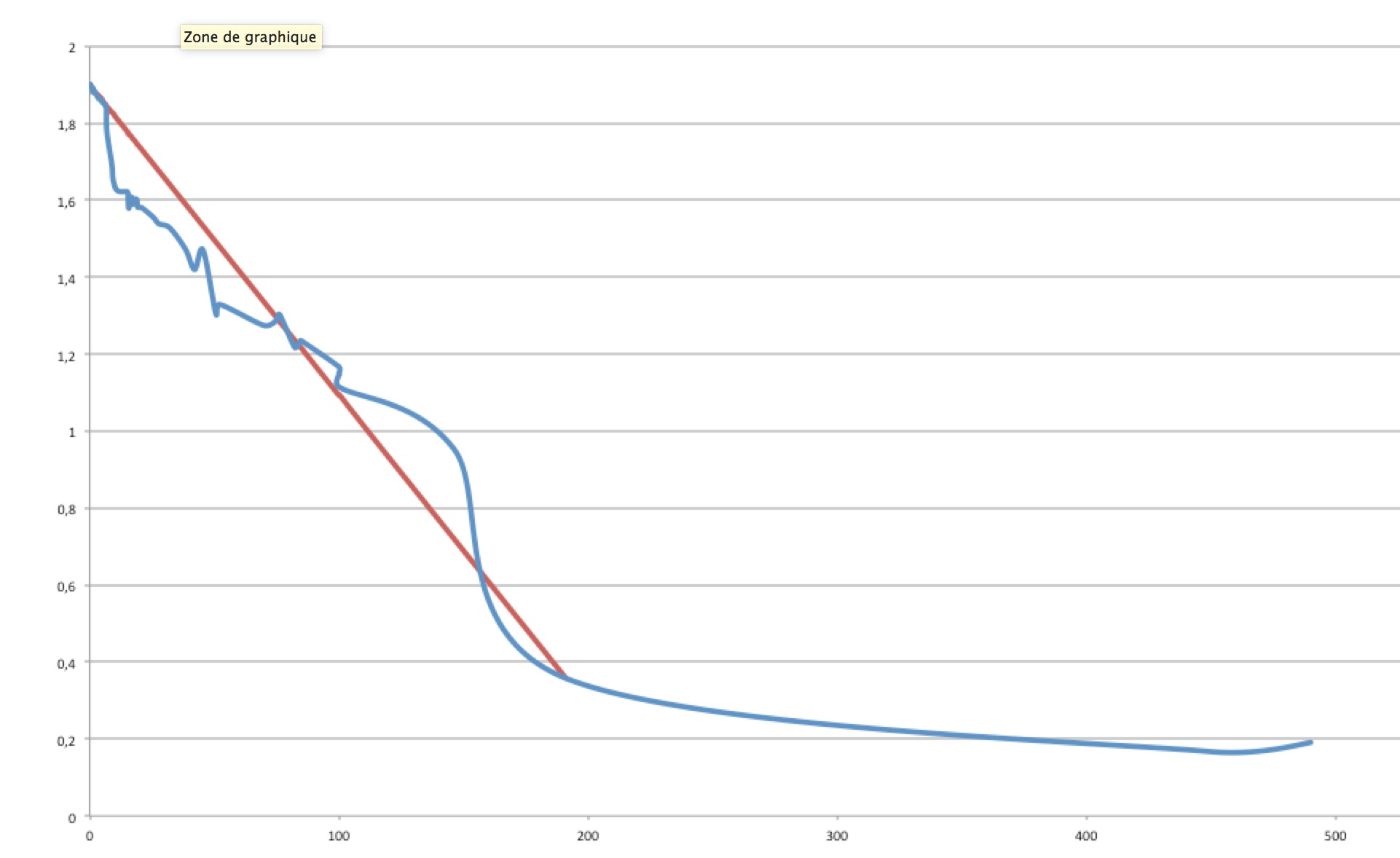
La zone 5mA-100mA sera ainsi beaucoup mieux modélisée par la courbe U = 1,63 - 6*I. La résistance interne est de 6 ohms.
Donc très grossièrement, cette pile a une résistance interne de 6-8 ohms.
Que peut-on espérer de cette pile de brousse ?
L'appareil électrique que je trouve incontournable dans le cadre d'une évacuation ou d'une situation de crise est la radio. On peut suivre l'évolution des évènements et la météo, à l'échelle locale (FM usuelle) mais aussi à l'international (Ondes Courtes, Moyennes et Longues).
Alimentée par deux piles 1,5V, donc 3V puisqu'elles sont reliées en série, cette radio peut en réalité tout à fait se satisfaire de plus d'un volt.
Il faut cependant choisir de l'alimenter directement via les connecteurs de piles car les entrées classiques ont une diode anti-retour, qui fait chuter d'environ 0.7V la tension d'alim.

Notre radio consomme 8.8mA :

Station radio captée à 8h18 :
Expérience commencée à 8h02, filmée à 8h18 (après tous les tests de surcharge et 16 min de radio) et poursuivie jusqu'à 8h33 pour au moins avoir 30 minutes de stats, et démontrer que c'est utilisable en bug out.
Les facteurs limitants de notre pile :
- le magnésium va être corrodé. On perd donc en masse. On peut montrer que cette masse est intrinsèquement liée à l'intensité demandée et à la durée d'utilisation.
- bien entendu, les caractéristiques globales vont dépendre de la qualité du magnésium (et du charbon).
Moins il est pur (si c’est un alliage par exemple), plus on va s'en éloigner.
L'expérience va générer un hydroxyde de magnésium, expliquant pourquoi il faut bien nettoyer la plaque après utilisation.
A quelle vitesse la réaction va-t-elle consommer notre magnésium ?
Un savant calcul permet d’estimer la consommation de magnésium pour fournir les électrons de la réaction.
Un ampère équivaut à 6,24 x 10^18 e/s
10mA représentent donc 6,24 x 10^16 électrons par seconde.
Un atome de Magnésium qui réagit va produire deux électrons, selon l'équation de réaction à l'anode, donc un courant de 10 mA va utiliser 3,12 x 10^16 atomes de magnésium. (3 avec 16 zéros après)...
Mon expérience ayant duré 30 minutes (1800 secondes), j'ai donc fait réagir 1800 * 3,12 x 10^16 Atomes de magnésium, ce qui représente 5,616 * 10^19 atomes (A)
Nous allons utiliser les moles et masses molaires.
Une mole représente 6,022 *10^23 atomes : NA, la constante d'Avogadro.
Nous avons donc A/ NA moles, soit 5,616/60220 moles, donc 0,000093258 mole, ou encore 0,093258 millimole (n)
La masse molaire du Magnésium M représente la masse en grammes d'une mole de magnésium. Elle vaut 24.3g/mol
On a une relation simple entre nombre de moles n, masse m et masse molaire : m = M * n
m = 0,093258*24.3 = 2.27
Rappelons que nous étions en millimoles, donc cette valeur est en milligrammes.
Une demi-heure d'utilisation avec une consommation de 10mA va consommer 2.27mg de magnésium. C'est imperceptible à l'échelle de notre expérience, qui d'ailleurs ne montre aucune différence -bien entendu- avec une balance précise au dixième de gramme près.


On peut cependant remarquer que le côté "actif" de l'électrode a bien été un peu attaqué :

Donc globalement -et théoriquement-, la quantité de magnésium consommée par heure sera de 4.5mg pour 10mA.
Ou, de manière condensée, la consommation sera de 4.5mg/h/10mA.
Notre bloc de magnésium pesant 37.6g, une consommation de 10mA peut assurer une autonomie théorique de 8350 heures, soit 348 jours.
Cela représente donc pile d'environ 1,6V et de capacité 83,5Ah....soit environ 133Wh à charge (1,6V).
C'est bien entendu une valeur très théorique, car le magnésium va être rongé non uniformément. Notre électrode va devenir un gruyère, et en dessous d'une certaine épaisseur, elle ne sera plus suffisamment rigide pour conserver son intégrité.
On ajoute à ceci des réactions parasites qui rongent l'électrode au fur et à mesure.
Je pense qu'un facteur 10 serait une bonne estimation de la durée de vie peut importent les paramètres initiaux.
Cela représente tout de même une trentaine de jours.
Juste pour terminer la démonstration, on remarque que si on réalise ce calcul avec une tension idéale (à vide, ce qui n'arrive jamais) de 3.1V, notre bloc présentera énergie de 83.5 * 3.1, soit 258.58 Wh.
Il pèse 37.6g, donc pour 1kg de magnésium, nous pourrions tirer (1000/37.6)*258.58 Wh, soit 6884Wh, ou encore 6.88kWh avec tous mes arrondis en cours de route.
C'est bien la densité énergétique massique donnée par la littérature.
On retombe bien sur nos pieds
Dans quelle mesure une pile MgO2 va-t-elle entrer en compétition avec vos poumons ?
En mode bug-in confiné -ou bunkerisé-, si vous contrôlez attentivement vos réserves d'oxygène, vous pourriez avoir des scrupules à utiliser cette technologie.
Une molécule de dioxygène va produire quatre électrons. En suivant le même raisonnement qu'avec le magnésium, on peut calculer que l'on a consommé 0,046629 millimole (0,093258/2, vu qu'un atome d'O2 produit deux fois plus d'électrons que de Mg) pour 10mA pendant une demi-heure, donc 0,093258mmol par heure (n)
Pour passer au volume de gaz V, on va utiliser le volume molaire d'un gaz parfait Vm : 22,414 l/mol.
Avec V = n * Vm = 2.09
n étant donné en millimoles, on a un facteur 1000 en jeu, on a donc ici 2 millilitres de dioxygène. Si on veut être picky, on considèrera que cela représente 10mL d'air, avec une concentration à 20% en O2 .
Donc cette pile va consommer 10mL "d'air" par heure par 10mA, soit 240mL "d'air" par jour sous une consommation de 10mA, soit un verre d'air, donc en gros moins qu'une inspiration.
En rappelant que l'on a consommé en vrai 48mL d'O2 , soit moins que le volume d'un paquet de mouchoir, par jour.
Brûler une allumette va consommer plus de dioxygène.
C'est donc tout à fait négligeable, même en environnement confiné, vous pouvez être rassurés !
Pour aller plus loin :
Il s’agit d’une pile tout à fait ordinaire, donc les mêmes règles s’appliquent. Si l’on souhaite une tension plus élevée, il est tout à fait possible de relier plusieurs éléments en série pour additionner leur tension. Ainsi, deux éléments en série (en reliant l’électrode au charbon de la première à l’électrode en magnésium de la seconde, on va former une batterie de piles qui aura une tension de 3,8V. Nous aurons 5,7V avec trois éléments, et ainsi de suite.
Pour les petits et grands :
Fabriquer une pile MgO2 à partir d'un bloc de magnésium est peut être inédit dans les thématiques prepper, mais cette technologie n'est pas totalement inexistante.
Bien qu'elle soit assez rarement documentée pour le public, elle se cache dans des jouets pour enfants, car elle est l'une des seules suffisamment puissantes pour alimenter de petits moteurs électriques. Voici donc deux jouets qui raviront vos enfants, tout en leur faisant découvrir la fabrication d’une pile non toxique.
Voici deux coffrets de jeux que j'ai trouvé sur le marché :
https://www.natureetdecouvertes.com/enfant/jeux-construction/jeux-motorises/vehicule-tout-terrain-a-eau-salee- 30148040
Le "véhicule tout terrain à eau salée" :
Très bien conçu, avec une bonne complexité :


et abondamment détaillé tant au niveau de l'assemblage du corps :
que de la pile :

De quoi occuper deux bonnes heures les enfants.
Il y a trois fines plaques de Magnésium de 0.5g chacune, permettant d’alimenter quatre heures chacune le moteur (qui consomme 40mA en régime normal)
Mesure de la tension à vide :

1,9V : On retrouve exactement la même tension qu'avec notre bloc.
Les plus attentifs auront remarqué que j'ai une tension négative. J'ai interverti les câbles de branchement par inadvertance à plusieurs reprises dans l'expérience...cela ne change bien entendu rien aux mesures.
A charge : Tension : 1.448V, Intensité : 16.9mA

Quand le moteur peine, on augmente la charge (en gros, le rotor tourne moins donc les bobinages réalisent des court-circuits plus longtemps).
A charge importante : Tension : 1.368V, Intensité : 45.9mA

La « voiture à eau salée, aux alentours de 4 euros :
https://www.cdiscount.com/juniors/plein-air/voiture-d-eau-salee-pour-enfants-energie-verte/f-1200442-ite0889123008878.html
Beaucoup plus simple, avec moins d'explications :


Deux plaques de magnésium de 0.15g chacune.
Amha une copie du précédent projet, car les indications de la pile sont quasi-identiques :

Mais je pense que la qualité du magnésium ou du charbon n'est pas la même car à solution saline identique, je ne suis pas arrivé à dépasser 1,4V.
Encore une fois, la tension ne dépend pas de la surface des électrodes, mais de leur composition, et de celle de l'électrolyte.
J'ai interverti les composés afin d'isoler les biais potentiels, avec solution saline identique. A noter que la permutation du papier buvard n'a pas donné de différence du tout.
La plaque de magnésium A sur le charbon actif B :

Cette plaque A permet une tension de 1,9V avec son électrode de charbon actif A. Avec le charbon B, la tension n'est que de 1,4V. On peut en conclure que la qualité de l'électrode de charbon joue un rôle très important dans la qualité finale.
A la loupe, on constate que la plaque A est beaucoup plus lisse et homogène :

Tandis que le charbon B laisse apparaître quasiment la trame métallique sur laquelle semble collée la poudre.

Il n'est pas impossible que le métal réalise une réaction parasite dans notre pile.
On remarque cependant qu'une électrode de fortune faite d'un charbon de pile et de granulés broyés permet d'atteindre de bons résultats.
La plaque de magnésium B sur le charbon actif A :

C'est déjà beaucoup mieux avec 1,7V, mais cela n'arrive pas exactement à la même tension qu'avec la plaque A.
On peut donc supposer que la qualité du magnésium n'est pas la même, avec toutes les approximations de mon expérience.
Mais réciproquement, si notre bloc acheté pour faire du feu permet d'atteindre 1,9V, cela suppose que le magnésium qui le compose est assez pur.
Ces différentes plaques m’ont permis de vous proposer un test assez simple qui permet de savoir si un blog de magnésium acheté dans le commerce est pur ou non. En effet, beaucoup de retex suspectent que le magnésium serait coupé avec de l'aluminium concernant les versions bon marché.
Si vous réalisez une pile avec ce bloc, alors la tension à vide doit être très proche de 1,9V, sinon, il s’agit sans doute d’un alliage.
Enfin, si on analyse les plaques de magnésium, on remarque qu'elles ne sont pas rongées de la même manière :

La plaque A présente une corrosion répartie sur la surface :

Tandis que la plaque B une corrosion par îlots :

Au microscope, on remarque mieux le phénomène :
A usage égal (au niveau temps et intensité), la plaque A est moins creusée :

Alors que B est parsemée de cratères :

Cela peut être dû à l'électrode de charbon, mais aussi à la qualité du magnésium.
Au final, cette hétérogénéité présente le risque de diminuer sévèrement l'autonomie, dans le sens où l'électrode B devient rapidement un gruyère et perd en rigidité, là où l'électrode A aura une corrosion mieux répartie sur la surface.
Bien que ces jeux fassent l’impasse sur le fonctionnement réel des piles, en suggérant que l’eau salée produit l’électricité, ils proposent une expérience intéressante pour petits et grands qui attisera leur curiosité, mais aussi la compréhension de la finalité des piles : s’il n’y a plus de métal, il n’y a plus d’énergie.
Je n’ai pas de Firesteel ni de plaques de Magnésium ; comment puis-je fabriquer cette pile ?
Nous sommes depuis notre enfance entourés de magnésium quasi-pur sans le savoir.
En effet, les petits taille-crayons que nous manipulions à l’école en sont composés, et permettront à tous d’expérimenter ce projet, sans risque ni investissement.
Tout d’abord, il faut bien différencier l’aluminium du magnésium. La photo ci-dessous présente le bloc de magnésium, et trois taille-crayons, dont un seul en aluminium, qui s’en détache clairement :

Les composants nécessaires pour fabriquer ces piles restent rudimentaires, et se trouveront dans toute habitation : des bouchons de bouteille en plastique, du fil, du charbon actif, un crayon à papier et un filtre à café.

Schéma de conception de notre pile :
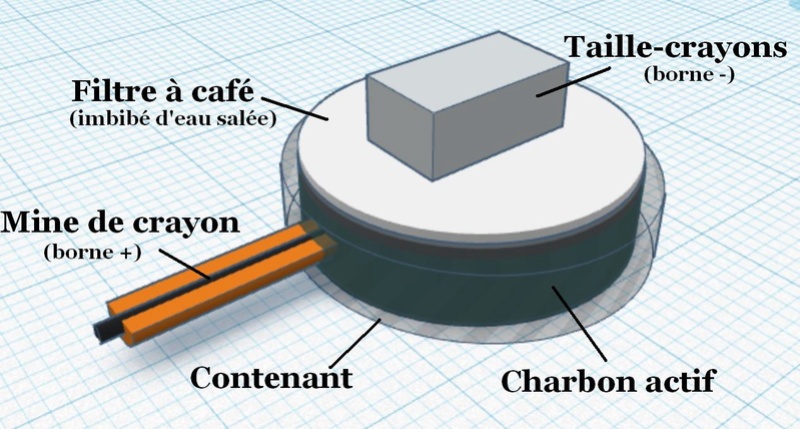
Le magnésium semble d’excellente qualité car nos deux piles en série forment une batterie avec une tension à vide de plus de 3.8 Volts.

Cela permet d’alimenter sans souci une LED blanche, dont la tension minimale est souvent de plusieurs Volts.

Comme les taille-crayons au magnésium sont assez purs, c’est une corde supplémentaire à votre arc : en environnement urbain dégradé, ils peuvent faire office de bloc de magnésium pour allumer un feu. Je vous le démontre sur cette vidéo :
Bonne expérience à tous, et n’hésitez pas à partager la vôtre ici !
Voici un tuto expliquant comment fabriquer une pile électrique très peu de moyens en extérieur. Nous alimenterons avec une petite radio FM, et nous terminerons avec une petite astuce qui vous permettra de récupérer du magnésium pur dans vos fonds de tiroir.

C'était à la base l'article que j'ai proposé à un membre de l'équipe de rédaction du Mag Survival, ici :
https://instinct-de-survie.forumgratuit.org/t11030-proposition-d-article-fabrication-d-une-pile-outdoor
Mais cela a pris beaucoup de temps (depuis novembre), normalement cela aurait dû paraître d'abord dans le Mag, afin de proposer une nouveauté, puis sur les forums les semaines suivantes pour compléter.
Donc à ceux qui nous rejoignent depuis le Mag Survival, voici la version complète de l'article, qui ne pouvait bien entendu pas entrer correctement dans le Mag, car elle prend 40 pages au total.
La version allégée s'étend sur 9 pages A4, tandis que celle du Mag condensée par la rédaction en fait 4 au maximum avec les photos...chapeau car c'était pas évident de proposer l'essentiel du propos sur si peu de place
Pour ceux qui préfèrent la version PDF, voici le fichier hébergé sur les serveurs d'Olduvaï (forum à l'origine de l'article) :
http://oldu.fr/docs/index.php?dir=1_Electricite/&file=Fabriquez_une_pile_de_fortune_avec_votre_bloc_de_magnesium.pdf
N'hésitez pas à poser ici vos questions et surtout à montrer vos réalisations
Il s'agit d'une petite amélioration de mon précédent article ici :
https://instinct-de-survie.forumgratuit.org/t6021-les-piles-diy-du-survivant
J'ai souhaité aller un peu plus loin ici ; vous aurez en effet des valeurs beaucoup plus précises de tension, d'intensité ainsi que les caractéristiques globales de notre pile. En effet, la plupart des expériences proposent les valeurs limites de tension et d'intensité, et multipliant l'une par l'autre pour estimer une puissance maximale. Mais dans la pratique cela ne fonctionne pas du tout, car plus on l’intensité débitée est élevée (plus « on tire » sur la pile), plus la tension s'effondre. Ces deux grandeurs sont intrinsèquement liées.
Nous verrons au travers de ce tuto que de nombreux concepts de chimie et d'électricité interviendront.
En effet, les piles métal-air fonctionnent avec de nombreux métaux. En mode bug-in, je suggèrerais plutôt l'aluminium, très présent dans toutes les habitations, sous forme de papier aluminium, d’emballage de tablettes de chocolat, ou encore de barquettes alimentaires. Un simple rouleau d’une dizaine de mètres permettrait de réaliser des centaines de piles Al-air, dont vous retrouverez les étapes de fabrication via le lien ci-dessus. Le seul facteur limitant sera plutôt le charbon.
Mais en bug-out, c'est à dire dans une situation "nomade", avec des ressources limitées, j'ai voulu proposer une possibilité qui réalise le meilleur compromis, avec ce que bon nombre d’entre nous possède déjà dans son paquetage : le bloc de magnésium.
On a donc un item qui peut faire double-emploi : il aide à allumer un feu (la poudre s'enflamme facilement) mais aussi à réaliser une pile électrique.
Le magnésium a un énorme avantage sur tous les autres métaux pour notre pile : la tension produite est l'une des plus élevées de toutes les expériences DIY réalisables.
Là où avec l'aluminium on produit péniblement 0,7V (1,2V théoriques) et où il faut soit relier plusieurs éléments en série soit ajouter un survolteur, avec le magnésium on peut atteindre une tension théorique de 3,1V !
Dans la pratique, sur le terrain et avec la plupart des électrolytes, nous obtiendrons environ 1,9V à vide. C'est beaucoup plus élevé que la plupart des piles que l'on peut trouver dans les expériences de chimie, comme la pile au citron Cuivre-Zinc.
C'est à dire qu'avec votre "pile de brousse", vous pourriez alimenter directement de petits appareils.
Enfin, je n'ai pas trouvé de tuto similaire sur les différents forums et sites web de notre thématique.
Si je ne me trompe pas, voici donc une première -et "frenchie"- dans le monde survival/bushcraft qui, je l'espère, ajoutera une corde supplémentaire à votre arc.
Il vous faudra :
- Votre bloc de magnésium. Mon modèle est un item d’entrée de gamme acheté 5 euros dans un magasin de rando.
- une électrode de charbon de récup. Une mine graphite de crayon à papier peut tout à fait convenir.
- du charbon actif. Celui-de ce tuto est issu de granulés d'un filtre à air. On peut utiliser tout type de charbon actif : d'aquarium, de masque à gaz, de cartouche filtrante (sans les granules échangeurs d'ions). Il est censé augmenter la surface de contact électrode/dioxygène/électrolyte, et donc augmenter l'intensité disponible.
Dans l’absolu, tout ce qui est en carbone assez pur fonctionne (électrode de pile, charbon de bois, crayon graphite, etc. le tout broyé), l'essentiel est d'avoir un composé neutre dans la réaction tout en étant bon conducteur électrique.
A l'extrême, pourquoi pas retenter la construction avec du charbon de bois récupéré du prochain barbeuc.
- des fils de connexion.
- un papier filtre à café ou du tissu assez fin.
- un peu de sel et d’eau

En premier lieu, je broie le charbon actif pour réaliser une poudre grossière :

Elle est ensuite enveloppée dans notre papier-tissu avec une électrode au milieu. C'est le même process qu'avec la pile aluminium-air.
L'ensemble est humidifié à l'aide de notre eau salée. J'ai utilisé 4g pour environ 20mL.
L'électrode avec le charbon actif sera la borne positive. Celle avec le magnésium sera la borne négative.

Si l'on analyse un peu la réaction chimique, cela devient évident.
L'électrode négative est appelée Anode (pensez au "n") ; elle va subir l'oxydation du magnésium en fournissant des électrons.
Réaction à l’anode : Mg -> Mg2+ + 2e-
A la cathode, le dioxygène de l'air est réduit en hydroxyde via l'eau de la solution
Réaction à l’anode Cathode: O2 + 2H2O + 4e- -> 4OH-
Mg2+g et OH- se combinent ensuite pour former de l'hydroxyde de magnésium, un solide blanc insoluble, qui va apparaître progressivement.
Soit l’équation bilan :
2Mg + O2 + 2H2O -> 2Mg(OH)2
Une pile qui fonctionne avec du Magnésium, de l’Oxygène et de l’eau salée
L’électrolyte de notre pile est tout simplement de l’eau salée à 20% (en g/L), c’est à dire à 200g pour 1000mL.
Cela représente environ 4 cuillères à café rases de sel pour une tasse à café d’eau. Ou bien 8 cuillères pour un gobelet en plastique jetable. Il n’est pas nécessaire d’être précis sur ce point, car le sel sert uniquement à rendre l'eau conductrice, et n'entre pas dans la réaction.
Avec notre solution, nous allons humidifier le charbon et la membrane. Il ne faut pas noyer l’ensemble car la réaction nécessite de l’oxygène, qui est apporté par le dioxygène présent dans l’air.
Le magnésium métallique Mg à la surface de notre bloc va être oxydé et se transformer en ion magnésium Mg2+ en perdant des électrons, qui vont être captés par l’électrode métallique. On la nomme « anode » dans le cas d’un générateur car elle fournit les électrons.
Le dioxygène de l’air O2 va être « réduit » au contact du charbon actif en se combinant à l’eau et en consommant des électrons pour former des ions hydroxyde OH-
D’un côté on a un excès d’électrons, de l’autre on a une carence. Si on relie ces deux électrodes avec un fil métallique, on permet aux électrons de circuler, donc on permet aux réactions de continuer. On forme alors tout simplement un circuit électrique.
Passons à la pratique !
Pour tracer la courbe caractéristique de notre pile, j'ai formé un circuit avec une résistance ajustable d'environ 100k. 100k opposent une résistance maximale, donc une intensité minimale tandis qu'au bas de l'échelle, nous descendons à quelques dizaines d'ohms, donc nous obtiendrons une intensité maximale.
J’ai utilisé deux multimètres, l’un permettant de suivre la tension, en mode Voltmètre, l’autre permettant de suivre l’intensité, en mode Ampèremètre.
La tension à vide (force électromotrice) de notre pile est de 1.9V.

Pas mal pour une pile de survie
Ici, c’est à peine moins car il y a en réalité ici 100k aux bornes de notre pile.
Donc, selon la loi d'ohm U = R*I (et I = U/R), une intensité de 19µA, invisible sur ce calibre de l'ampèremètre. J'ai oublié ce point lors de l'expérience...
C'est bien mieux que les piles AlO2, qui arrivent assez péniblement à 0.7V, mais aussi des piles cuivre/zinc que l'on bidouille avec les citrons (0.9V).
Petit rappel :
- une intensité est un débit d'électrons. C'est comme mesurer le débit d'une rivière. L'instrument de mesure - un ampèremètre- se place donc sur le chemin du courant. C'est pourquoi on dit qu'il est "en série" dans le circuit.

- une tension est une différence de potentiel entre deux points et se mesure donc "aux bornes d'un dipôle", ici une résistance.
C'est pourquoi on place l'instrument de mesure -un voltmètre- en parallèle à un composant dans le circuit.

Si l'on souhaite suivre l'évolution des deux paramètres en même temps, il suffit de placer les deux instruments comme suit :

Théoriquement, ces instruments ne perturbent pas le circuit. Cela reste vrai dans la plupart des montages usuels, comme celui-ci.
Mais dès que l'on touche aux circuits oscillants (radio, HF, etc.) ou à forte impédance (alim de compteur Geiger...), ils risquent de les faire un peu dévier.
Puis on réalise des mesures à différentes valeurs d'intensité :
1.81V lorsque ma résistance laisse passer un courant de 1,5mA.

Mesure avec un courant de presque 10mA débité dans la résistance :

etc.
Je suis monté à presque 0.5 ampères, mais la tension est tombée à 0.2 volts !
A noter que faire débiter de fort courant à une pile l’endommage un peu, comme une pile normale. La tension maximale va progressivement décroître avec l’utilisation. Lors de la réaction chimique, de l’eau est consommée et un oxyde métallique est produit.
Si l’on souhaite repartir de zéro, il suffit de nettoyer un peu le bloc de magnésium et de rincer à l’eau claire le charbon. La réaction va continuer tant que le métal, le dioxygène et l’électrolyte sont disponibles.
Voici la courbe caractéristique de notre pile, qui représente la tension (en volts, en ordonnées) qui varie selon l'intensité du courant dans le circuit (en milliampères, en abscisses).

On remarque que
- pour les faibles courants, en dessous de 5mA, la tension reste assez stable autour de 1.8V.
- entre 5mA et 100mA, la tension décroît en suivant presque une droite,
- au dessus de 100mA, la tension s'effondre. On s'approche alors d'un court-circuit.
C'est tout à fait normal car la surface des électrodes où se produit la réaction chimique est très petite, à peine 4 cm2 ; on ne peut fournir une quantité illimitée de courant.
Très sommairement et sans entrer dans les détails, notre pile présente une f.e.m (tension à vide), mais aussi une résistance interne, due à ses constituants. C'est comme si on avait une résistance supplémentaire en série dans le circuit, qui va faire d'autant chuter la tension que l'intensité demandée est élevée.
La tension U d'une pile s'écrit en général U = f.e.m - R * I.
A noter que la résistance interne va dépendre de l'électrolyte et de la concentration des ions en solution...mais aussi de la surface des électrodes.
Plus cette surface sera grande, plus notre pile pourra fournir de courant, et donc tenir la charge face à des intensités importantes.
Essayons de calculer R : On va voir qu'elle varie un petit peu au cours de l'expérience.
Pour les faibles intensités, on peut modéliser la caractéristique par U = 1,9- 8*I. La résistance interne est de huit ohms.

Mais à partir de 5mA, on s'éloigne drastiquement de la réalité.
Astuce pour ceux qui utilisent les tableurs : il est quasi-impossible d'avoir une échelle linéaire en abscisse avec les graphiques en mode ligne.
Il faut alors utiliser les nuages de points avec lignes de jonction, ce qui revient quasi- au même !
Avec une échelle linéaire, cet éloignement à la réalité saute aux yeux :

La zone 5mA-100mA sera ainsi beaucoup mieux modélisée par la courbe U = 1,63 - 6*I. La résistance interne est de 6 ohms.

Donc très grossièrement, cette pile a une résistance interne de 6-8 ohms.
Que peut-on espérer de cette pile de brousse ?
L'appareil électrique que je trouve incontournable dans le cadre d'une évacuation ou d'une situation de crise est la radio. On peut suivre l'évolution des évènements et la météo, à l'échelle locale (FM usuelle) mais aussi à l'international (Ondes Courtes, Moyennes et Longues).
Alimentée par deux piles 1,5V, donc 3V puisqu'elles sont reliées en série, cette radio peut en réalité tout à fait se satisfaire de plus d'un volt.
Il faut cependant choisir de l'alimenter directement via les connecteurs de piles car les entrées classiques ont une diode anti-retour, qui fait chuter d'environ 0.7V la tension d'alim.

Notre radio consomme 8.8mA :

Station radio captée à 8h18 :
Expérience commencée à 8h02, filmée à 8h18 (après tous les tests de surcharge et 16 min de radio) et poursuivie jusqu'à 8h33 pour au moins avoir 30 minutes de stats, et démontrer que c'est utilisable en bug out.
Les facteurs limitants de notre pile :
- le magnésium va être corrodé. On perd donc en masse. On peut montrer que cette masse est intrinsèquement liée à l'intensité demandée et à la durée d'utilisation.
- bien entendu, les caractéristiques globales vont dépendre de la qualité du magnésium (et du charbon).
Moins il est pur (si c’est un alliage par exemple), plus on va s'en éloigner.
L'expérience va générer un hydroxyde de magnésium, expliquant pourquoi il faut bien nettoyer la plaque après utilisation.
A quelle vitesse la réaction va-t-elle consommer notre magnésium ?
Un savant calcul permet d’estimer la consommation de magnésium pour fournir les électrons de la réaction.
Un ampère équivaut à 6,24 x 10^18 e/s
10mA représentent donc 6,24 x 10^16 électrons par seconde.
Un atome de Magnésium qui réagit va produire deux électrons, selon l'équation de réaction à l'anode, donc un courant de 10 mA va utiliser 3,12 x 10^16 atomes de magnésium. (3 avec 16 zéros après)...
Mon expérience ayant duré 30 minutes (1800 secondes), j'ai donc fait réagir 1800 * 3,12 x 10^16 Atomes de magnésium, ce qui représente 5,616 * 10^19 atomes (A)
Nous allons utiliser les moles et masses molaires.
Une mole représente 6,022 *10^23 atomes : NA, la constante d'Avogadro.
Nous avons donc A/ NA moles, soit 5,616/60220 moles, donc 0,000093258 mole, ou encore 0,093258 millimole (n)
La masse molaire du Magnésium M représente la masse en grammes d'une mole de magnésium. Elle vaut 24.3g/mol
On a une relation simple entre nombre de moles n, masse m et masse molaire : m = M * n
m = 0,093258*24.3 = 2.27
Rappelons que nous étions en millimoles, donc cette valeur est en milligrammes.
Une demi-heure d'utilisation avec une consommation de 10mA va consommer 2.27mg de magnésium. C'est imperceptible à l'échelle de notre expérience, qui d'ailleurs ne montre aucune différence -bien entendu- avec une balance précise au dixième de gramme près.


On peut cependant remarquer que le côté "actif" de l'électrode a bien été un peu attaqué :

Donc globalement -et théoriquement-, la quantité de magnésium consommée par heure sera de 4.5mg pour 10mA.
Ou, de manière condensée, la consommation sera de 4.5mg/h/10mA.
Notre bloc de magnésium pesant 37.6g, une consommation de 10mA peut assurer une autonomie théorique de 8350 heures, soit 348 jours.
Cela représente donc pile d'environ 1,6V et de capacité 83,5Ah....soit environ 133Wh à charge (1,6V).
C'est bien entendu une valeur très théorique, car le magnésium va être rongé non uniformément. Notre électrode va devenir un gruyère, et en dessous d'une certaine épaisseur, elle ne sera plus suffisamment rigide pour conserver son intégrité.
On ajoute à ceci des réactions parasites qui rongent l'électrode au fur et à mesure.
Je pense qu'un facteur 10 serait une bonne estimation de la durée de vie peut importent les paramètres initiaux.
Cela représente tout de même une trentaine de jours.
Juste pour terminer la démonstration, on remarque que si on réalise ce calcul avec une tension idéale (à vide, ce qui n'arrive jamais) de 3.1V, notre bloc présentera énergie de 83.5 * 3.1, soit 258.58 Wh.
Il pèse 37.6g, donc pour 1kg de magnésium, nous pourrions tirer (1000/37.6)*258.58 Wh, soit 6884Wh, ou encore 6.88kWh avec tous mes arrondis en cours de route.
C'est bien la densité énergétique massique donnée par la littérature.
A magnesium-air fuel cell has theoretical operating voltages of 3.1V and energy densities of 6.8 kWh/kg
On retombe bien sur nos pieds
Dans quelle mesure une pile MgO2 va-t-elle entrer en compétition avec vos poumons ?
En mode bug-in confiné -ou bunkerisé-, si vous contrôlez attentivement vos réserves d'oxygène, vous pourriez avoir des scrupules à utiliser cette technologie.
Une molécule de dioxygène va produire quatre électrons. En suivant le même raisonnement qu'avec le magnésium, on peut calculer que l'on a consommé 0,046629 millimole (0,093258/2, vu qu'un atome d'O2 produit deux fois plus d'électrons que de Mg) pour 10mA pendant une demi-heure, donc 0,093258mmol par heure (n)
Pour passer au volume de gaz V, on va utiliser le volume molaire d'un gaz parfait Vm : 22,414 l/mol.
Avec V = n * Vm = 2.09
n étant donné en millimoles, on a un facteur 1000 en jeu, on a donc ici 2 millilitres de dioxygène. Si on veut être picky, on considèrera que cela représente 10mL d'air, avec une concentration à 20% en O2 .
Donc cette pile va consommer 10mL "d'air" par heure par 10mA, soit 240mL "d'air" par jour sous une consommation de 10mA, soit un verre d'air, donc en gros moins qu'une inspiration.
En rappelant que l'on a consommé en vrai 48mL d'O2 , soit moins que le volume d'un paquet de mouchoir, par jour.
Brûler une allumette va consommer plus de dioxygène.
C'est donc tout à fait négligeable, même en environnement confiné, vous pouvez être rassurés !
Pour aller plus loin :
Il s’agit d’une pile tout à fait ordinaire, donc les mêmes règles s’appliquent. Si l’on souhaite une tension plus élevée, il est tout à fait possible de relier plusieurs éléments en série pour additionner leur tension. Ainsi, deux éléments en série (en reliant l’électrode au charbon de la première à l’électrode en magnésium de la seconde, on va former une batterie de piles qui aura une tension de 3,8V. Nous aurons 5,7V avec trois éléments, et ainsi de suite.
Pour les petits et grands :
Fabriquer une pile MgO2 à partir d'un bloc de magnésium est peut être inédit dans les thématiques prepper, mais cette technologie n'est pas totalement inexistante.
Bien qu'elle soit assez rarement documentée pour le public, elle se cache dans des jouets pour enfants, car elle est l'une des seules suffisamment puissantes pour alimenter de petits moteurs électriques. Voici donc deux jouets qui raviront vos enfants, tout en leur faisant découvrir la fabrication d’une pile non toxique.
Voici deux coffrets de jeux que j'ai trouvé sur le marché :
https://www.natureetdecouvertes.com/enfant/jeux-construction/jeux-motorises/vehicule-tout-terrain-a-eau-salee- 30148040
Le "véhicule tout terrain à eau salée" :
Très bien conçu, avec une bonne complexité :


et abondamment détaillé tant au niveau de l'assemblage du corps :

que de la pile :

De quoi occuper deux bonnes heures les enfants.
Il y a trois fines plaques de Magnésium de 0.5g chacune, permettant d’alimenter quatre heures chacune le moteur (qui consomme 40mA en régime normal)
Mesure de la tension à vide :

1,9V : On retrouve exactement la même tension qu'avec notre bloc.
Les plus attentifs auront remarqué que j'ai une tension négative. J'ai interverti les câbles de branchement par inadvertance à plusieurs reprises dans l'expérience...cela ne change bien entendu rien aux mesures.
A charge : Tension : 1.448V, Intensité : 16.9mA

Quand le moteur peine, on augmente la charge (en gros, le rotor tourne moins donc les bobinages réalisent des court-circuits plus longtemps).
A charge importante : Tension : 1.368V, Intensité : 45.9mA

La « voiture à eau salée, aux alentours de 4 euros :
https://www.cdiscount.com/juniors/plein-air/voiture-d-eau-salee-pour-enfants-energie-verte/f-1200442-ite0889123008878.html
Beaucoup plus simple, avec moins d'explications :


Deux plaques de magnésium de 0.15g chacune.
Amha une copie du précédent projet, car les indications de la pile sont quasi-identiques :


Mais je pense que la qualité du magnésium ou du charbon n'est pas la même car à solution saline identique, je ne suis pas arrivé à dépasser 1,4V.
Encore une fois, la tension ne dépend pas de la surface des électrodes, mais de leur composition, et de celle de l'électrolyte.
J'ai interverti les composés afin d'isoler les biais potentiels, avec solution saline identique. A noter que la permutation du papier buvard n'a pas donné de différence du tout.
La plaque de magnésium A sur le charbon actif B :

Cette plaque A permet une tension de 1,9V avec son électrode de charbon actif A. Avec le charbon B, la tension n'est que de 1,4V. On peut en conclure que la qualité de l'électrode de charbon joue un rôle très important dans la qualité finale.
A la loupe, on constate que la plaque A est beaucoup plus lisse et homogène :

Tandis que le charbon B laisse apparaître quasiment la trame métallique sur laquelle semble collée la poudre.

Il n'est pas impossible que le métal réalise une réaction parasite dans notre pile.
On remarque cependant qu'une électrode de fortune faite d'un charbon de pile et de granulés broyés permet d'atteindre de bons résultats.
La plaque de magnésium B sur le charbon actif A :

C'est déjà beaucoup mieux avec 1,7V, mais cela n'arrive pas exactement à la même tension qu'avec la plaque A.
On peut donc supposer que la qualité du magnésium n'est pas la même, avec toutes les approximations de mon expérience.
Mais réciproquement, si notre bloc acheté pour faire du feu permet d'atteindre 1,9V, cela suppose que le magnésium qui le compose est assez pur.
Ces différentes plaques m’ont permis de vous proposer un test assez simple qui permet de savoir si un blog de magnésium acheté dans le commerce est pur ou non. En effet, beaucoup de retex suspectent que le magnésium serait coupé avec de l'aluminium concernant les versions bon marché.
Si vous réalisez une pile avec ce bloc, alors la tension à vide doit être très proche de 1,9V, sinon, il s’agit sans doute d’un alliage.
Enfin, si on analyse les plaques de magnésium, on remarque qu'elles ne sont pas rongées de la même manière :

La plaque A présente une corrosion répartie sur la surface :

Tandis que la plaque B une corrosion par îlots :

Au microscope, on remarque mieux le phénomène :
A usage égal (au niveau temps et intensité), la plaque A est moins creusée :

Alors que B est parsemée de cratères :

Cela peut être dû à l'électrode de charbon, mais aussi à la qualité du magnésium.
Au final, cette hétérogénéité présente le risque de diminuer sévèrement l'autonomie, dans le sens où l'électrode B devient rapidement un gruyère et perd en rigidité, là où l'électrode A aura une corrosion mieux répartie sur la surface.
Bien que ces jeux fassent l’impasse sur le fonctionnement réel des piles, en suggérant que l’eau salée produit l’électricité, ils proposent une expérience intéressante pour petits et grands qui attisera leur curiosité, mais aussi la compréhension de la finalité des piles : s’il n’y a plus de métal, il n’y a plus d’énergie.
Je n’ai pas de Firesteel ni de plaques de Magnésium ; comment puis-je fabriquer cette pile ?
Nous sommes depuis notre enfance entourés de magnésium quasi-pur sans le savoir.
En effet, les petits taille-crayons que nous manipulions à l’école en sont composés, et permettront à tous d’expérimenter ce projet, sans risque ni investissement.
Tout d’abord, il faut bien différencier l’aluminium du magnésium. La photo ci-dessous présente le bloc de magnésium, et trois taille-crayons, dont un seul en aluminium, qui s’en détache clairement :

Les composants nécessaires pour fabriquer ces piles restent rudimentaires, et se trouveront dans toute habitation : des bouchons de bouteille en plastique, du fil, du charbon actif, un crayon à papier et un filtre à café.

Schéma de conception de notre pile :

Le magnésium semble d’excellente qualité car nos deux piles en série forment une batterie avec une tension à vide de plus de 3.8 Volts.

Cela permet d’alimenter sans souci une LED blanche, dont la tension minimale est souvent de plusieurs Volts.

Comme les taille-crayons au magnésium sont assez purs, c’est une corde supplémentaire à votre arc : en environnement urbain dégradé, ils peuvent faire office de bloc de magnésium pour allumer un feu. Je vous le démontre sur cette vidéo :
Bonne expérience à tous, et n’hésitez pas à partager la vôtre ici !

Dernière édition par Métatarse le Mer 30 Mai 2018 - 7:29, édité 1 fois (Raison : Edit pour le Mag)














 , il est incroyable ce tuto et surtout tres instructif ; Punaise ca nous replonge dans nos cours de physique au bahut !
, il est incroyable ce tuto et surtout tres instructif ; Punaise ca nous replonge dans nos cours de physique au bahut !