Comme promis lors de ma présentation, voici une petite synthèse présentant la fabrication de javel, en vue de purifier notre eau.
Par purifier, j'entends bien entendu la potabilisation d'un point de vue biologique, et non pas chimique (solvants, essence, radiotoxiques, etc...), auquel cas seule la distillation fractionnée arrive à bout.
Ce post a été développé à l'origine sur Olduvaï, et suite à la demande de Fantôme, le voici compilé ici afin de pouvoir échanger avec vous des questions, améliorations, et éclaircissements.
L'investissement tourne autour de 1€ en comptant une pile et des crayons. Il y a très peu de risques, le dichlore produit étant immédiatement capté par les hydroxydes pour former la javel. Néanmoins, pour la forme, je ne pourrai être tenu responsable d'un quelconque dommage sur quiconque....
Pour ceux qui compilent des fiches, j'avais également édité le post en format PDF ici : Purification / Désinfection de l'eau par Electrolyse : synthèse d'hypochlorite
Ce PDF est en consultation libre, mais pour l'édition ou l'intégration à d'autres œuvres, merci de me demander l'autorisation (j'ai déjà eu des soucis), je la donne souvent
Qu'est ce que la javel ?
Une molécule oxydante, capable d'arracher des électrons aux autres molécules.
L'action désinfectante tient au fait que la javel attaque la membrane plasmique ainsi que les protéines de toutes les cellules du monde vivant; c'est un bactéricide (bactéries gram+ et gram) – dont la legionella, fongicide, sporicide, prionicide, et virucide (dont l'hépatite).On connaît très peu d'organismes capables de résister à l'oxydation de la javel, ce qui en fait un produit de choix pour la purification de l'eau, mais aussi en guise de désinfectant.
L'idée principale de ce projet est d'expliquer comment fabriquer simplement cette molécule en grande quantité. Ceci pouvant s'intégrer dans plusieurs scénarios :
- pénurie de javel suite à des épidémies (vous vous souvenez du trempage des chaussures pour le personnel lors des épisodes de SRAS ou de la grippe aviaire ?)
- paupérisation, mettant hors de portée du citoyen lambda les produits d'hygiène de base
- effondrement civilisationnel (k2kk).
Je tiens à préciser que la molécule de javel a une durée limitée dans le temps, et c'est d'autant plus critique que la solution de base est concentrée et que la température de stockage est élevée :
Une solution concentrée à 16% tombe ainsi à 2% en un peu plus de 8 semaines à 40°C, et à 8% en un an à 20°C. Source : http://membres.multimania.fr/microbio/actualites/Javel/image_272.gif
Une solution concentrée se dégrade ainsi inéluctablement, et un stock de javel reste problématique en prévision d'un scénario sus-cité. On peut contourner le problème avec des poudres qui libèrent la javel seulement au contact de l'eau, mais le budget grimpe alors assez vite.
La production de javel permet en outre de stériliser une eau qui l'a déjà été, mais qui a reposé longtemps dans une cuve.
Très sommairement, la production de javel consiste en une électrolyse d'eau salée.
Avant de l'aborder, il est intéressant de commencer par l'électrolyse de l'eau pure :
Électrolyse de l'eau :
L'eau pure est légèrement conductrice d'électricité car elle contient des ions (2 molécules d'eau H2O se dissocient constamment en H3O (oxonium) et HO- (hydroxyde). Cependant, l'eau présente naturellement dans notre environnement n'est jamais pure et contient en plus beaucoup d'ions (calcium, chlore, etc..) qui assurent une meilleure conductivité.
Dans une électrolyse simple, avec uniquement de l'eau dans la cuve, nous pouvons recréer deux gaz communs : le dioxygène et le dihydrogène. En effet, quand on fait passer un courant électrique dans l'eau (électro - lyse), on casse la molécule H2O en 2H+ et O-. Ces ions se recombinent en O2 (à l'anode) et H2 (à la cathode) : les deux gaz qui se forment aux électrodes.
Image wiki :
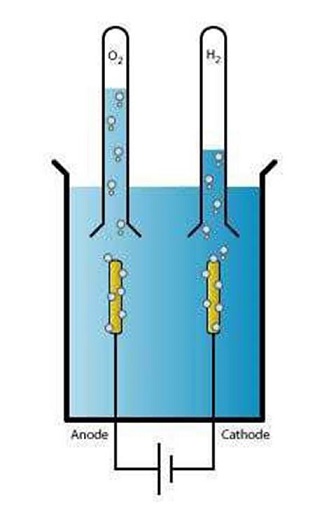
Selon l'équation globale 2H2O => O2 + H2
À la cathode se déroule la réduction de l’eau :
2H2O + 2e- => 2OH- + H2
À l’anode se déroule l’oxydation de l'eau :
2H2O => O2 + 4H + 4e-
L'électrolyse de l'eau démarre sous une tension de 1,3V, mais pour s'amorcer idéalement, on choisit une tension entre 1,5V et 2V. Le fait d'utiliser une tension supérieure est totalement inutile car ce courant sera entièrement dissipé par effet joule, donc en pure perte. C'est pour cette raison que l'on réalise plutôt des électrolyse avec 2V sous 100A en multipliant les électrodes (rendement 98%, risque d'électrisation quasi nul) que sous 220V avec 1A (rendement 1%, risque d'électrocution important car I=U/Rhumain).
Pour ma part, j'ai utilisé pour alimentation lors de cette expérience une lampe à dynamo. Elle fournit une tension continue de 5V en charge, et 3,6V sur l'accumulateur au lithium.
Mais rien n'empêche d'utiliser de simples piles 1,5V que l'on aura sorti d'une lampe torche. A défaut, il est possible d'utiliser une pile plate 4,5V pour simplifier les manips.
Électrolyse de l'eau salée : la production de javel.
La réaction globale de l’électrolyse est décrite par l’équation :
À la cathode se déroule la réduction de l’eau :
2H2O + 2e- => 2OH- + H2
À l’anode se déroule l’oxydation des ions chlorure :
2Cl- => Cl2 + 2e-
(en plus de la réaction d'électrolyse de l'eau 2H2O => O2 + 4H+ + 4e-)
L’équation globale correspondante est :
2Cl- + 2H2O => 2OH- + H2 + Cl2
Comme l’électrolyse est effectuée de manière à ce que les produits formés ne soient pas séparés, l’hydroxyde (de sodium) et le dichlore réagissent pour former de l’hypochlorite (de sodium aqueux)selon la réaction suivante :
Cl2 + 2OH- => ClO- + Cl- + H2O
Le chlore est ici à la fois oxydant et réducteur, on a donc une dismutation.
(HClO n'existe pas en milieu basique, causé par les ions OH-, et se transforme en ion ClO-)
La réaction est bien visible. On voit le mélange buller et très vite l'odeur de javel arriver. S'il ne se passe rien, vérifier s'il n'y a pas un mauvais branchement, ou un court-circuit entre deux électrodes.
Dans mon tuto, je montrais l'importance de bien choisir ses électrodes. En effet, elles doivent absolument être inertes pour la réaction, au risque de produire des molécules indésirables (si en métal, des sels métalliques toxiques).
La meilleure version que j'aie pu obtenir utilise des électrodes de graphite, issues de crayon à papier (le carbone et la bentonite ne réagissent pas). Coût : 50cts les 10.
Pour séparer les mines des crayons, le mieux est de les faire tremper dans de l'eau chaude; les trois parties se séparent ensuite assez bien.
Vue des électrodes :

Le premier fil fait des zig zag de manière à être relié à une tige de graphite à droite, puis à gauche, puis à droite et en fin à gauche, et inversement pour le 2e.
J'ai procédé ainsi car cela facilitait l'enroulage du fil de cuivre autour des électrodes (c'est insoudable) en suivant les zig zag, mais aussi cela semble améliorer le brassage des ions par une répartition mieux équilibrée et éviter ainsi tout risque de dégagement de dichlore. Mais cette disposition n'est pas obligatoire.
Dans la version initiale (ci-dessus), les électrodes sont tenues par des plaques en plastique rigide. Je conseille fortement d'utiliser à la place du polystyrène de 2cm d'épaisseur. Les électrodes sont ainsi plus simples à placer (en enfonçant les mines sans forcer), mais aussi beaucoup mieux fixées; l'ensemble est par ailleurs quasi-hermétique (et peut être transporté avec la javel préparée) alors que l'autre fuyait un peu.

Je conseille les charbons des piles plate 4,5V. Ils sont tout à fait appropriés pour les autres expériences d'électrolyse (6mmØ, 5cm de long), mais étant donné que l'enjeu est la potabilité de l'eau, on ne va pas prendre le risque d'utiliser des électrodes pouvant être couvertes de substances de pile, même à l'état de trace (nickel, manganèse, zinc, etc...).
Par ailleurs, les électrodes de piles au charbon sont sujettes à l'attaque de la javel produite. On s'en rend compte avec un dépôt de poudre noir au fond de la cuve.
Enfin, il est bien entendu possible d'augmenter le nombre d'électrodes afin de produire de la javel en plus grande quantité, moyennant une consommation proportionnelle sur les piles.
Afin de tester de manière plus poussée cette expérience, j'avais préparé six pots de verre stérilisés , avec un bouillon de culture : l'eau de récup d'une forêt le bouillon (jus de viande et bouillon cube) 1 mL de la solution à divers moment. Une sert de témoin envers l'eau récupérée, et une autre sert de témoin pour le bouillon de culture.
Malheureusement,absolument rien ne s'est développé dans les boites testées avec cette solution, donc le seuil de désinfection devait vraisemblablement être dépassé.
J'ai recommencé l'expérience un peu plus tard, mais je n'ai jamais eu de développement de souches.
Dégradation de l'eau de Javel :
En abandonnant l'eau de Javel à l'air, l'hypochlorite se décompose à la suite de plusieurs phénomènes simultanés :
- Il réagit avec le gaz carbonique de l'air selon :
NaClO + CO2 + H2O => NaHCO3 + HClO : l'hydrogénocarbonate de sodium (bicarbonate de soude)
- à la lumière, HClO se décompose selon :
2 HClO => 2 HCl + O2 et le HCl formé est neutralisé par l'hydroxyde en solution (le NaOH), ce qui reforme du sel (NaCl) et de l'eau.
En résumé, l'eau de Javel a tendance à redevenir du sel, et du bicarbonate.
Pour être parfaite, cette étude devrait ajouter un test viral, et un test cryptogamique, afin d'en connaître le degré de désinfection.
En tant que source au sujet de la désinfection, je cite ce document :
L'action désinfectante de l’Eau de Javel (CNRS)
" />
L’action désinfectante de l’Eau de Javel en milieu aqueux est principalement liée à l’action de l’acide hypochloreux (HOCl). Cette forme peu ionisée du chlore dans l’eau pénètre facilement au travers des parois et des membranes cellulaires des entités microscopiques : virus, bactéries, spores, champignons, parasites. Dans certaines situations, la forme chlore gazeux (Cl2) peut même exister lorsque des pH inférieurs à 4 existent localement; elle pénètre très facilement les membranes cellulaires.
Le chlore actif libre présent dans la solution agira de 2 façons : par un caractère oxydant général et par l’action immédiate et spécifique de chloration des fonctions aminées des protéines.
Dans un environnement contenant des matières azotées (ammonium ou amines), le chlore actif sera consommé avec formation de monochloramines. Les monochloramines sont elles-mêmes légèrement désinfectantes. Suivant la concentration en acide hypochloreux et les temps de contact avec les micro-organismes,
l’action pourra être majoritairement inhibitrice ou destructrice ou une combinaison des deux.
La forme la plus évidente de l’efficacité destructrice de ce produit est l’éclatement des bactéries. Certaines molécules de HOCl peuvent en effet pénétrer jusqu’au cytoplasme de la bactérie et agir sur les protéines dirigeant les fonctions vitales de la bactérie. Par contre en face des prions, des virus ou des membranes des bactéries gram et gram -, l’action de l’acide hypochloreux sur les fonctions aminées inhibera l’action de ces prions, virus ou bactéries. Pour les autres micro-organismes : champignons, parasites et spores, une combinaison de ces différents modes d’action aura lieu. Pour chacun des micro-organismes, on peut déterminer la combinaison d’une concentration en chlore résiduel et d’un temps de contact spécifique en vue de l’inhiber ou de le détruire plus ou moins totalement.
Donc au niveau du dosage, 10mL doivent assurer une désinfection complète, 5mL une simple purification d'eau claire. Il conviendrait évidemment d'adapter ces quantités en fonction du degré initial de pureté de l'eau (l'hypochlorite réagit avec les particules en suspension) et de sa température (il faut augmenter alors la quantité). En toutes circonstances, la concentration requise en hypochlorite de sodium dépend de la concentration de ces polluants. Spécialement, la quantité de matière organique polluante détermine la concentration en hypochlorite requise. Si l'eau est filtrée avant l'adjonction, moins d'hypochlorite est nécessaire.
Dans le doute, on peut dépasser les dosages de javel, mais il faudra alors attendre plus longtemps avant consommation.
Voilà pour le petit tuto. Je précise que cette expérience est à la portée de tous. Vous serez surpris de constater l'odeur très forte qui va vernir piquer vos narines (n'abusez pas !). Une fois que l'on maîtrise cette technologie, on peut alors songer au nombre de fois où l'humanité aurait pu l'utiliser....ou pourrait à l'heure actuelle sur une bonne partie de la planète.
Bons bidouillages !
Dernière édition par Nemrod le Mar 16 Fév 2016 - 13:28, édité 7 fois (Raison : Précisions)


































 .
.